Science子刊:肿瘤无处逃!临床前研究表明三特异性duoCAR-T细胞可有效治疗抗原异质性癌症
来源:本站原创 2021-04-03 11:18
2021年4月3日讯/生物谷BIOON/---随着靶向CD19的嵌合抗原受体(CAR)T细胞(CAR-T)疗法(CAR19 T细胞)和靶向CD22的CAR-T细胞疗法(CAR22 T细胞)的出现,对B细胞白血病和淋巴瘤的治疗有了明显的改善。然而, CAR-T细胞治疗后的复发仍是一个障碍,而且有多达50%的接受CAR19 T细胞治疗的患者在治疗后第一年内复发,
2021年4月3日讯/生物谷BIOON/---随着靶向CD19的嵌合抗原受体(CAR)T细胞(CAR-T)疗法(CAR19 T细胞)和靶向CD22的CAR-T细胞疗法(CAR22 T细胞)的出现,对B细胞白血病和淋巴瘤的治疗有了明显的改善。然而, CAR-T细胞治疗后的复发仍是一个障碍,而且有多达50%的接受CAR19 T细胞治疗的患者在治疗后第一年内复发,这些复发患者的相当一部分人表现出CD19抗原丢失。同样地,CAR22 T细胞治疗急性淋巴细胞白血病(ALL)后的复发与恶性肿瘤细胞的CD22蛋白下调有关,以至于CAR22 T细胞无法再识别和杀死它们。在先利用CAR19 T细胞治疗再利用CAR22 T细胞治疗的过程中,CD19和CD22肿瘤表面抗原的顺序丢失也在弥漫性大B细胞淋巴瘤中有报道。同样地,在CD20靶向抗体利妥昔单抗(Rituximab)治疗过程中,CD20抗原丢失在非霍奇金淋巴瘤、慢性淋巴细胞白血病(CLL)和滤泡性淋巴瘤中有报道。为了解决肿瘤抗原逃逸的问题,来自美国Lentigen公司的研究人员之前已经开发了一种靶向CD19和CD20抗原的串联双特异性CAR20-19构建体,并在1期临床试验中显示出有前景的疗效和耐受性。
利用多特异性CAR-T细胞靶向肿瘤细胞据推测可减轻肿瘤抗原逃逸,提高治疗效果。此前,Lentigen研究人员已在在人源化小鼠异种移植模型中证实,duoCAR-T细胞(双CAR-T细胞,即表达两个串联在一起的CAR的T细胞)在控制HIV感染方面比monoCAR-T细胞(单CAR-T细胞,即表达单个CAR的T细胞)更有效。
如今,在一项新的研究中,Lentigen研究人员让表达靶向CD19和CD20的串联CAR的慢病毒载体转导原代CD4+ T细胞和CD8+ T细胞,所表达的串联CAR通过P2A自切割肽与靶向CD22抗原的monoCAR操作性连接在一起,据此开发出三特异性duoCAR-T 细胞,并评估了这种三特异性duoCAR-T 细胞解决抗原逃逸问题的能力。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Trispecific CD19-CD20-CD22–targeting duoCAR-T cells eliminate antigen-heterogeneous B cell tumors in preclinical models”。

这些作者构建出4种duoCAR构建体(称为D1、D2、D3和D4),每个构建体的两个开放阅读框都被一个P2A肽隔开,它们在T细胞表面上的表达谱如图1所示。DuoCAR D1由靶向B细胞抗原CD19和CD20的串联单链可变区片段(scFv)结合结构域、来源于CD8的铰链和跨膜结构域、ICOS共刺激结构域、CD3激活结构域以及位于CD3激活结构域之后的第一代靶向CD22的CAR基因、来源于CD8的铰链和跨膜结构域、CD3激活结构域组成。D2与D1相同,只是用OX40结构域代替了ICOS共刺激结构域。D3含有与构建体D2相同的靶向CD19和CD20的串联CAR基因,该串联CAR基因后面是一个靶向CD22的 CAR基因、第二代ICOS共刺激结构域和CD3激活结构域。D4含有靶向CD20和CD19的串联CAR基因和CD27共刺激结构域,还含有靶向CD22的CAR基和ICOS共刺激结构域,此外每个共刺激结构域后面是一个CD3激活结构域。

图1.双顺反子DuoCAR D1、D2、D3和D4设计、表达和表征。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
将每种duoCAR构建体转导原代人T细胞,由此获得duoCAR D1 T细胞、duoCAR D2 T细胞、duoCAR D3 T细胞和duoCAR D4 T细胞,并在体外培养中增殖8-10天。基于四项独立的转导实验,duoCAR D1的平均表达为64%,D2为56%,D3为60%,D4为45%。这些作者能够持续制造duoCAR-T细胞,而且这些duoCAR-T细胞没有任何不希望的自发激活、衰竭或终末分化的证据。
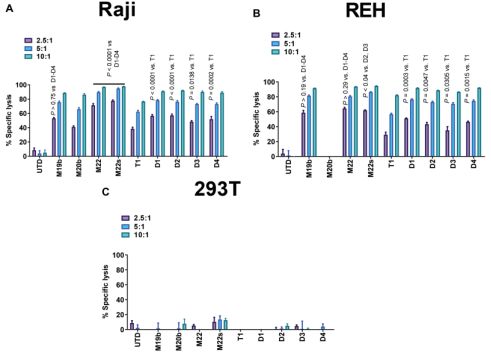
图2.DuoCAR D1、D2、D3和D4在体外对肿瘤细胞具有较强的特异性毒性。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
他们利用肿瘤细胞系Raji(CD19+CD20+CD22+)和REH(CD19+CD20-CD22+)进行体外测试,发现相比于monoCAR-T 细胞,duoCAR T细胞更强效地裂解Raji细胞和REH细胞,但是没有一种duoCAR T细胞裂解靶抗原阴性细胞系293T(CD19-CD20-CD22-),这表明这种肿瘤杀伤作用并不是抗原非依赖性的(图2)。此外,他们还发现这四种duoCAR细胞在外能够特异性表达三种表面抗原(CD19、CD20和CD22)中任何一种组合(比如仅表达其中的一种抗原、仅表达其中的两种抗原和表达这三种表面抗原)的肿瘤细胞(图5)。
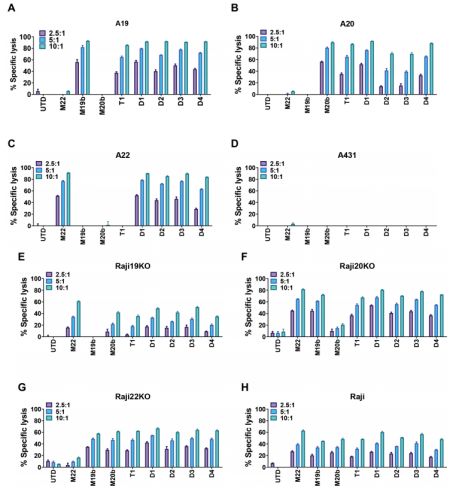
图5.CAR-T细胞对抗原工程靶细胞的体外细胞毒性研究。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
他们还收集duoCAR T细胞与Raji细胞系一起在体外培养时的上清液,并测量上清液中duoCAR T细胞分泌的可溶性细胞因子。他们发现duoCAR T细胞产生细胞因子IL-2、IFN-γ、TNF-α、GM-CSF和IL-9,此外在一定程度上还产生IL-4。正如预期的那样,未用携带CAR的慢病毒载体转导的T细胞(下称UTD T细胞)并不产生细胞因子,从而证实这种细胞因子产生依赖于CAR(图3)。
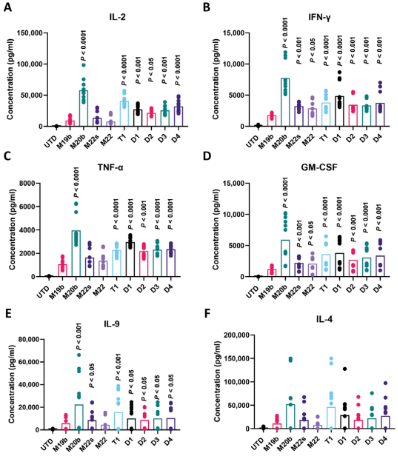
图3.在与CD19+CD20+细胞系Raji共培养时,CD22+CAR-T释放的细胞因子。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
接着,他们在体内测试了duoCAR-T细胞的疗效。为此,他们在Raji NHL肿瘤异种移植小鼠模型和NALM-6 ALL小鼠模型中测试了duoCAR-T细胞,在这两种小鼠模型中,每种模型都呈现三阳性CD19+CD20+CD22+抗原表达表型。在Raji NHL肿瘤异种移植小鼠模型中,给每只小鼠注射的duoCAR-T细胞剂量分为高剂量(5×106)和低剂量(2×106),结果发现在高剂量组中,这四种duoCAR-T细胞在第14天开始显著地和强效地抑制Raji肿瘤生长,而在低剂量组中,这四种duoCAR-T细胞都能控制Raji肿瘤负荷。在NALM-6 ALL小鼠模型中,这四种duoCAR-T细胞介导了显著的肿瘤排斥反应(图4)。
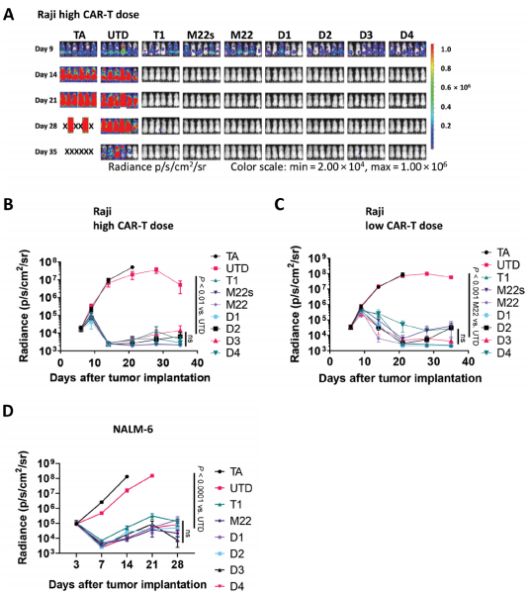
图4.DuoCAR-T细胞根除淋巴瘤和白血病异种移植模型中的B细胞肿瘤。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
此外,为了测试duoCAR-T细胞对抗原丢失的肿瘤细胞突变体的抗肿瘤功能,给NSG小鼠体内植入5×106 Raji细胞(由Raji19KO细胞、Raji20KO细胞、Raji22KO细胞和亲代Raji细胞组成,每种细胞占25%)。这种Raji细胞混合物代表着一种抗原异质性肿瘤,在这种肿瘤中,一些肿瘤细胞在一定程度上丢失了靶抗原的表达,比如Raji19KO细胞不表达CD19,Raji20KO细胞不表达CD20,Raji22KO细胞不表达CD22,而这种靶抗原表达的丢失会阻止相应的CAR-T细胞激活和抗肿瘤免疫。在注射这种Raji细胞混合物7天后,这些小鼠接受5×106个duoCAR D1/D2/D3/D4 T细胞和作为对照的monoCAR-T细胞。在第14天时,他们发现这四种duoCAR T细胞强效地排斥抗原异质性的Raji肿瘤,而且在这项研究结束时,这些小鼠仍然保持病情缓解状态。相反之下,monoCAR-T细胞不能控制对照组小鼠体内的肿瘤负荷(图6)。
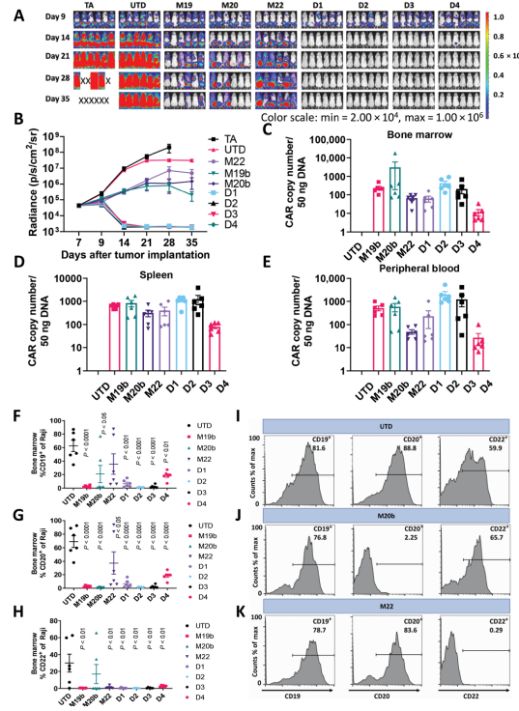
图6.在抗原异质性Raji肿瘤模型中,duoCAR在体内的抗肿瘤活性和持久性。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401。
此外,他们还发现当结合靶细胞上的表面抗原时,与monoCAR设计相比,duoCAR构建体能够使CD3强健地磷酸化,并激活下游信号传导蛋白Akt和MAPK p38,以及远端信号介质STAT5。此外,这种duoCAR设计保留了同源monoCAR的关键激活特征,而且激活幅度极小下降或没有下降。
总之,这项研究在体外和体内证实了duoCAR-T细胞的高功能性。这种方法广泛解决了抗原异质性的紧迫问题。此外,这些作者发现了一个未预料到的不包括CD28或4-1BB结构域的最佳共刺激结构域的组合,这表明科学家们对与高活性和长期持久性相关的T细胞信号转导的理解仍在继续完善。在CAR-T方法被认为得到真正优化之前,必须考虑到激活(由CD3磷酸化可知)、长期持续性(由Akt激活所示)以及对通常由细胞因子介导的生理信号作出的反应(比如STAT5磷酸化)。此外,从p38和Erk1/2磷酸化来看,duoCAR中一些激活信号的减少表明,最大的初始激活可能与疾病控制不相关。这项研究开发的duoCAR-T细胞方法在当前CAR-T细胞疗法的基础上进行了改进,克服了肿瘤异质性和肿瘤抗原逃逸的临床挑战,同时保较高的抗肿瘤效力和持久性。(生物谷 Bioon.com)
参考资料:
Dina Schneider et al. Trispecific CD19-CD20-CD22–targeting duoCAR-T cells eliminate antigen-heterogeneous B cell tumors in preclinical models. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abc6401.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


