淋巴瘤新药!CD19靶向抗体药物偶联物(ADC)loncastuximab tesirine(Lonca)在美国申请上市!
来源:本站原创 2020-09-23 14:52
Lonca治疗弥漫性大B细胞淋巴瘤(DLBCL)的总缓解率达48.3%、完全缓解率24.1%。

2020年09月23日讯 /生物谷BIOON/ --ADC Therapeutics SA是一家处于后期临床阶段的瑞士生物技术公司,致力于开发和商业化治疗血液恶性肿瘤和实体瘤的高效靶向抗体药物偶联物(ADC)。近日,该公司宣布,已向美国食品和药物管理局(FDA)提交了loncastuximab tesirine(Lonca,前称ADCT-402)的生物制品许可申请(BLA),该药用于治疗复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)。
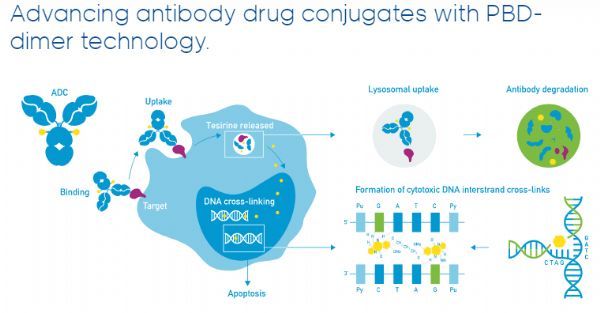
loncastuximab tesirine(Lonca)是一种靶向CD19的ADC疗法,由一种人源化抗人CD19单克隆抗体通过连接器与吡咯并苯并二氮杂卓(pyrrolobenzodiazepine,PBD)二聚体细胞毒素偶联而成。一旦与表达CD19的细胞结合,Lonca就会被细胞内化,随后释放出细胞毒素,该毒素能不可逆地与DNA结合,从而产生阻止DNA链分离的强力链间交联,从而破坏复制等必要的DNA代谢过程,最终导致细胞死亡。CD19是一个经验证的治疗B细胞恶性肿瘤的热门靶点。
抗体药物偶联物-PBD二聚体技术
Lonca BLA的提交,基于来自关键2期LOTIS 2研究的数据。这是一项多中心、开放标签、单臂临床试验,评估了Lonca治疗先前接受过至少2种系统疗法的复发或难治性DLBCL患者的疗效和安全性。2020年6月,该公司在第25届欧洲血液学会(EHA)虚拟会议上公布了来自LOTIS 2的成熟数据:截止2020年4月6日数据截止日期,共145例患者入组研究,这些患者先前接受的系统疗法中位数为3种。
结果显示,Lonca的客观缓解率(ORR)为48.3%(70/145例)、完全缓解率(CR)为24.1%(35/145例)。研究中,Lonca的耐受性总体上是可控的,发生在≥10%患者中的最常见≥3级治疗期间出现的不良事件(TEAE)为:中性粒细胞减少症(25.5%)、发热性中性粒细胞减少症(3.4%)、血小板减少症(17.9%)、GGT升高(16.6%)和贫血(10.3%)。
该公司还启动了LOTIS 5,这是Lonca与利妥昔单抗联合应用的验证性3期临床试验,旨在支持一项补充BLA,将Lonca作为治疗复发或难治性DLBCL的二线疗法。(生物谷Bioon.com)
原文出处:ADC Therapeutics Submits Biologics License application to the U.S. Food and Drug Administration for Loncastuximab Tesirine for Treatment of Relapsed or Refractory Diffuse Large B-cell Lymphoma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->