Trends in Immunology:NLRP3炎症小体活性通过细胞器应激的脂质调节
来源:生物谷 2021-08-27 17:11
多种内源性脂类,包括氧化低密度脂蛋白(oxLDL)、饱和脂肪酸(SFA)和鞘脂,能激活哺乳动物NLRP3炎症小体并促进某些炎症疾病的进展。
多种内源性脂类,包括氧化低密度脂蛋白(oxLDL)、饱和脂肪酸(SFA)和鞘脂,能激活哺乳动物NLRP3炎症小体并促进某些炎症疾病的进展。NLRP3的脂质激活剂通常具有共同的特征,如慢启动动力学和为炎症小体激活提供启动和触发信号的能力,并且NLRP3的脂质激活需要细胞器应激,特别是线粒体、溶酶体和内质网的细胞器应激,而某些脂质的衰减可以抑制NLRP3的活性。
图片来源:https://doi.org/10.1016/j.it.2021.07.005
巨噬细胞中NLRP3炎症小体引发的炎症是影响越来越多个体慢性代谢性疾病的重要因素,这些疾病中多数都涉及内源性脂质或其氧化产物的病理积累,而这些物质可以激活NLRP3。然而,其他内源性脂质可以抑制NLRP3的激活,这些脂质调节NLRP3活性的细胞内机制目前尚不明了。该研究表明细胞器应激,特别是涉及线粒体、溶酶体和内质网,可能是脂质诱导的NLRP3炎症小体活性修饰的关键。
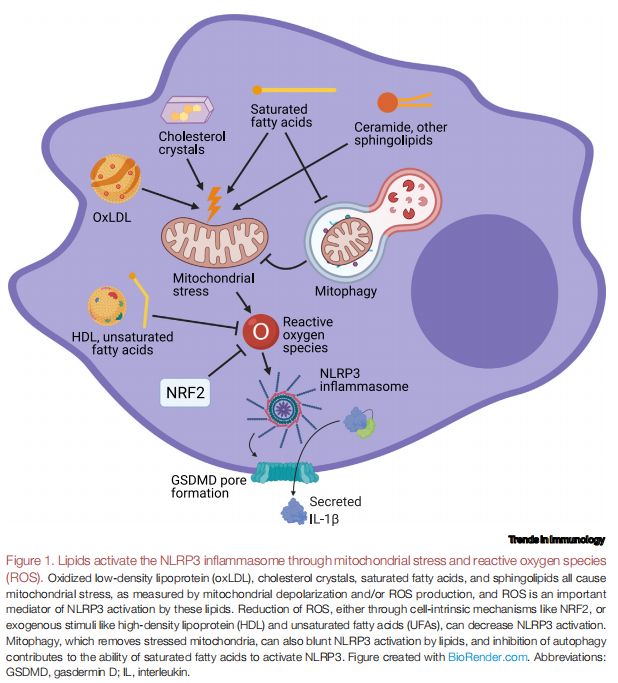
脂质通过线粒体应激和活性氧(ROS)激活NLRP3炎症小体 图片来源:https://doi.org/10.1016/j.it.2021.07.005
oxLDL、胆固醇晶体、SFA和鞘脂都会引起线粒体应激,通过线粒体去极化和/或ROS产生来衡量,而ROS是这些脂质激活NLRP3的重要介质。通过细胞内在机制(如核因子E2相关因子2[NRF2])或外源性刺激(如高密度脂蛋白[HDL]和不饱和脂肪酸 [UFA])减少ROS,以此来减少NLRP3的激活。线粒体自噬可以去除线粒体应激,也可以减弱脂质对NLRP3的激活,抑制自噬有助于SFA激活NLRP3的能力。该研究假设,不同于严重损害膜结合细胞器的触发器,SFA可能会通过抑制通常会清除受损细胞器的自噬途径,从而在这些细胞器中逐渐积累压力,这大概需要数小时累积的细胞器损伤来触发NLRP3,并猜测ROS的积累可能会导致这种压力的逐渐积累。
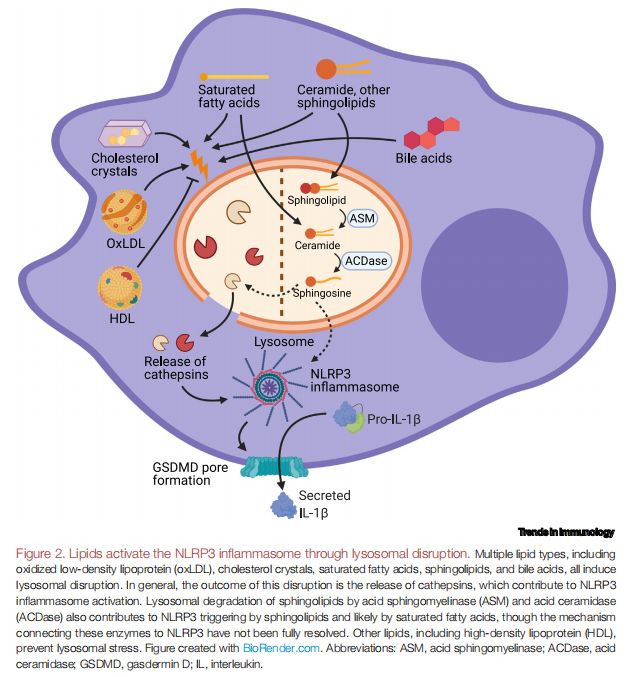
脂质通过溶酶体破坏激活NLRP3炎症小体 图片来源:https://doi.org/10.1016/j.it.2021.07.005
溶酶体损伤下游的主要机制被认为是溶酶体组织蛋白酶的释放,尤其是组织蛋白酶B,尽管其他组织蛋白酶也被认为在NLRP3触发中起作用。溶酶体破坏也已成为由几种结构类别的脂质引起的NLRP3激活的关键步骤,如多种类型的脂质,包括oxLDL、胆固醇晶体、SFA、鞘脂和胆汁酸,都会引起溶酶体破坏。一般来说,这种破坏的结果是导致组织蛋白酶释放,有助于激活NLRP3炎症小体。酸性鞘磷脂酶(ASM)和酸性神经酰胺酶(ACDase)对鞘脂的溶酶体降解也有助于激活由鞘脂和可能由饱和脂肪酸触发的NLRP3,尽管将这些酶与NLRP3联系起来的机制尚未清晰,而其他脂质,包括HDL,可防止溶酶体应激。
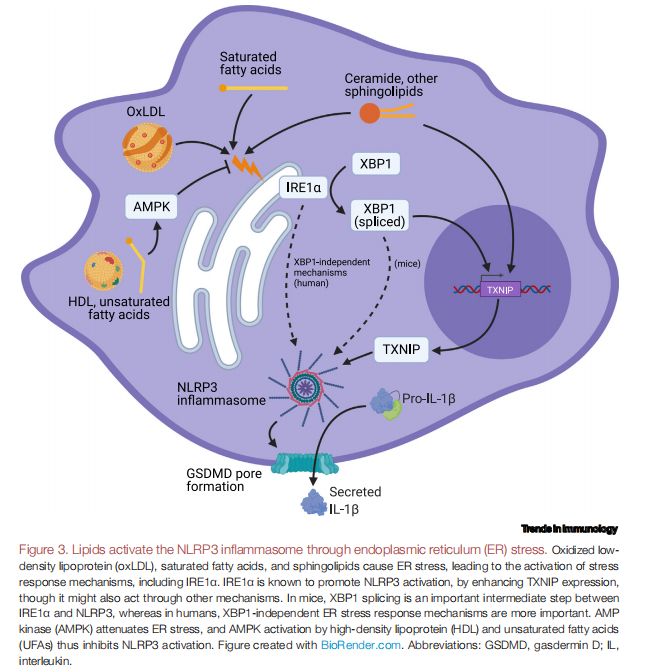
脂质通过内质网(ER)应激激活NLRP3炎症小体 图片来源:https://doi.org/10.1016/j.it.2021.07.005
几类脂质在小鼠和人类巨噬细胞中引起ER应激,表明ER应激也可能在NLRP3炎性体的脂质触发中发挥重要作用,如oxLDL、SFA和鞘脂会引起ER应激,从而激活包括肌醇依赖酶1α(IRE1α)在内的应激反应机制。已知IRE1α通过增强硫氧还蛋白互作蛋白(TXNIP)表达来促进NLRP3激活,尽管它也可能通过其他机制起作用,在小鼠中,X-盒结合蛋白1(XBP1)剪接是IRE1α和NLRP3之间重要的中间步骤,而在人类中,不依赖于XBP1的ER应激反应机制更为重要。AMP活化蛋白激酶(AMPK)减弱ER应激,HDL、UFA和丁酸盐激活AMPK,它通过多种细胞器应激相关机制抑制NLRP3的激活,包括促进小鼠腹腔巨噬细胞的自噬和减轻3T3-L1脂肪细胞系中的ER应激。UFA还可以促进自噬,同时降低小鼠骨髓来源的巨噬细胞(BMDM)和腹膜巨噬细胞中的ER应激,表明AMPK可能是NLRP3的UFA和HDL抑制的关键介质。
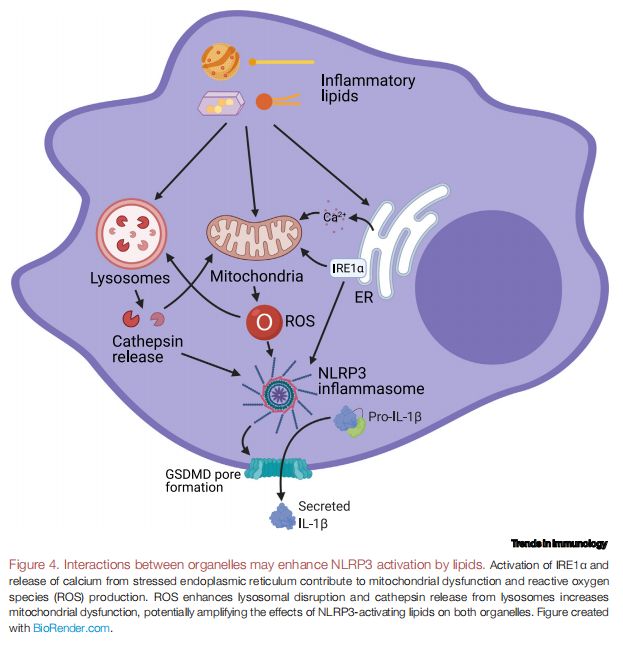
细胞器之间的相互作用可能会增强脂质对NLRP3的激活 图片来源:https://doi.org/10.1016/j.it.2021.07.005
IRE1α的激活和ER应激中钙的释放导致线粒体功能障碍和ROS的产生。ROS会增强溶酶体的破坏,而溶酶体的组织蛋白酶释放会增加线粒体功能障碍,从而可能会放大NLRP3激活脂质对两种细胞器的影响。有研究表明,溶酶体和线粒体在脂毒性条件下(如SFA超载)之间的相互作用可能会促进NLRP3激活,SFA处理的肝细胞中溶酶体释放的组织蛋白酶B有助于人肝细胞癌(HepG2)细胞中的线粒体去极化,并且通过Mito-TEMPO(一种线粒体靶向超氧化物歧化酶,有着清除超氧化物和烷基自由基的能力)抑制线粒体ROS延迟了小鼠BMDM中的溶酶体透化。
确定细胞器应激作为脂质诱导的NLRP3活性的关键共享调节器可能部分解释了为什么NLRP3是许多代谢疾病的核心,并指出了新的研究问题,这些问题可以更准确地定义细胞器应激在NLRP3激活中的作用。通过成像技术(例如超分辨率显微镜和活细胞报告各种细胞器中的压力)来促进该领域的进一步研究,以定义这些压力的动力学以及这与炎性体组装时间的关系。此外,新兴的类器官和芯片上组织模型可能有助于弥合现有细胞和动物模型研究之间的差距,从而有助于更好地了解NLRP3的药理学靶向或之前讨论的细胞器应激途径如何在可实现的情况下对抗动脉粥样硬化、II型糖尿病、非酒精性脂肪肝和其他与脂质诱导的NLRP3激活相关的疾病。(生物谷 bioon)
参考文献
Jonathan J. Liang et al. Lipid regulation of NLRP3 inflammasome activity through organelle stress. Trends in Immunology (2021 July 29) doi:https://doi.org/10.1016/j.it.2021.07.005
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



