Science论文解读!开发出CiBER-seq新技术,可同时分析细胞中的多达100个基因
来源:本站原创 2020-12-16 10:11
2020年12月16日讯/生物谷BIOON/---CRISPR-Cas9可以很容易地敲除或调整单个基因,以确定其对有机体或细胞,甚至另一个基因的影响。但是,如果你能一次进行几千个实验,利用CRISPR逐个对基因组中的每一个基因进行调整,并快速看到每一个基因的影响呢,那会怎么样呢?在一项新的研究中,来自美国加州大学伯克利分校的研究人员开发出一种简单的方法来做到
2020年12月16日讯/生物谷BIOON/---CRISPR-Cas9可以很容易地敲除或调整单个基因,以确定其对有机体或细胞,甚至另一个基因的影响。但是,如果你能一次进行几千个实验,利用CRISPR逐个对基因组中的每一个基因进行调整,并快速看到每一个基因的影响呢,那会怎么样呢?
在一项新的研究中,来自美国加州大学伯克利分校的研究人员开发出一种简单的方法来做到这一点,它让任何人都可以对细胞(包括人类细胞)进行分析,并迅速确定基因组中所有调控特定基因表达的DNA序列。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes”。
虽然这项技术将主要受益于对影响感兴趣基因的遗传网络进行追踪的基础研究人员,它也将帮助人们快速找到控制疾病基因的调控序列,并可能找到新的药物靶点。
论文通讯作者、加州大学伯克利分校分子与细胞生物学副教授Nicholas Ingolia说,“你可能想要使用这种方法的疾病是癌症,在癌症中,我们知道癌细胞为了生存和生长而表达且是需要表达的某些基因。这个工具会让你问问题:上游基因是什么,哪些是我们知道的控制这些基因的调节因子?”
这些调节因子可能更容易通过药物加以靶向以关闭癌细胞。这种新技术简化了一些直到现在都很难做到的事情:沿着细胞中的遗传途径回溯,以找到这些最终的调节因子。
他说,“我们有很多向前工作的好方法。这是一种很好的逆向工作的方法,可用于弄清楚一些东西的上游是什么。我认为它在疾病研究方面有很多潜在的用途。”
他补充道,“我有时会打个比方,当我们走进一间黑暗的房间,按一下电灯开关,我们就能看到打开的是什么灯。这个灯就像一个基因,当我们按下开关,我们就能知道它开启了什么基因。我们已经在这方面做得很好了。这让我们可以做的是逆向工作。如果我们关注一个灯,我们想知道控制它的开关是什么。这给我们提供了一种方法来做到这一点。”
Ingolia实验室的研究生Ryan Muller及其同事Lucas Ferguson、Zuriah Meacham与Ingolia在Science期刊上发表了他们开发的这种技术的细节。
对基因组进行条码化处理
自从8年前CRISPR-Cas9基因编辑技术出现以来,想要确定某个特定基因功能的科学家们已经能够用Cas9蛋白精确地靶向该基因并将其敲除。在一段与该基因中的DNA互补的向导RNA(gRNA)的引导下,Cas9蛋白结合并切割该基因,或者像CRISPR干扰(CRISPRi)那样,抑制它。
在最简单的测试中,细胞或有机体要么生存,要么死亡。然而,可以寻找基因敲除的更微妙的影响,例如特定基因是否开启或关闭,或者它被调高或调低了多少。
如今,这需要添加一个报告基因--通常是一个编码绿色荧光蛋白的基因,所添加的报告基因连接到启动你感兴趣的基因表达的启动子的相同拷贝上。由于每个基因独特的启动子决定了该基因的表达时间,如果Cas9基因敲除影响了你感兴趣的基因的表达,也会影响报告基因的表达,使细胞培养物在荧光灯下发绿光。
尽管如此,酵母的全部基因有6000个--而人类的全部基因有2万个---要调整每个基因并发现对荧光报告基因的影响是一项大工程。
他说,“CRISPR使得全面调查基因组中的所有基因并对它们进行扰动变得很容易,但随后最大的问题是,你如何读出每个扰动的效果?”
这种新技术,Ingolia称之为CiBER-seq(CRISPR interference with barcoded expression reporter sequencing),解决了这个问题,通过让数万个CRISPR实验合并在一起,同时完成这些实验。该技术摒弃了荧光,采用深度测序的方式,直接测量合并样本(pooled sample)中基因活性的增加或减少。深度测序采用高通量、长读的新一代测序技术,对合并样本中表达的所有基因进行测序和基本计数。
Ingolia说,“在合并的CiBER-seq实验中,在一天之内,我们可以找到几个不同靶基因的所有上游调控因子,而如果你要使用基于荧光的技术,每一个靶基因都需要你花费多天的测量时间。”
对生物体内的每个基因进行平行CRISPR分析是很直接的,这要归功于那些出售现成的、与Cas9蛋白一起使用的单向导RNA(sgRNA)的公司。科学家们可以为基因组中的每个基因订购sgRNA,为每个基因可以订购十几种不同的sgRNA---大多数基因都是由数千个核苷酸组成的,而sgRNA的长度大约为20个核苷酸。
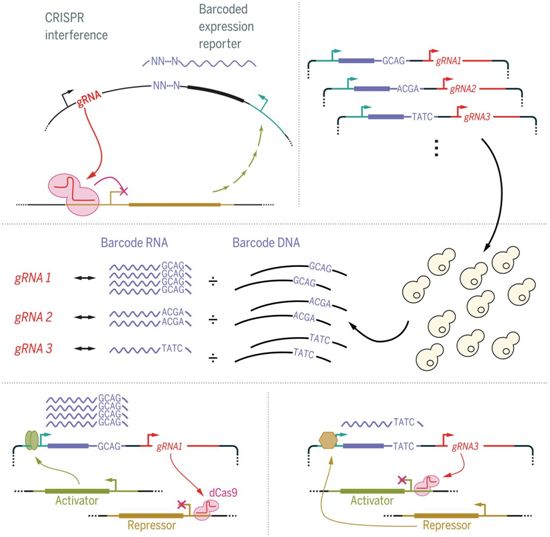
Ingolia团队的关键创新是将每个sgRNA与一个独特的、随机的核苷酸序列---本质上是一个条形码---连接到启动子上,只有当感兴趣的基因也被开启时,该启动子才会转录条形码序列。每个条形码可报告一个sgRNA的效果;在成千上万个sgRNA的复杂文库中,一个sgRNA靶向作用于一个基因。深度测序可以告诉你样品中每个条形码(对酵母而言,大约有6万个条形码)的相对丰度,让你快速评估酵母中6000个基因中的哪一个对启动子有影响,从而对感兴趣的基因的表达有影响。对于人类细胞来说,可能会插入20多万个不同的gRNA,多次靶向作用于每个基因。
他说,“这才是我们能够做到与众不同的关键:你有一个由不同的gRNA组成的大型文库,每一个gRNA都会扰动不同的基因,但它上面有同一个查询启动子(query promoter)--你正在研究的反应。这个查询启动子转录了我们链接到每个gRNA的随机条形码。如果存在一个你关心的反应,你就干扰一下基因组中的每个不同基因,看看这种反应是如何变化的。”
例如,如果你得到的一个条形码比其他任何一个条形码都要丰富10倍,那就告诉你该查询在细胞中被强烈开启了10倍的启动子。在实践中,Ingolia在每个gRNA上附加了大约四个不同的条形码,作为对结果的四重检查。
他说,“通过更直接地观察基因表达反应,我们可以发现很多微妙的生理学本身,细胞内部发生了什么。”
在这些新报道的实验中,Ingolia团队查询了酵母中的五个不同基因,包括参与新陈代谢、细胞分裂和细胞应激反应的基因。虽然在对整个基因组进行CRISPR分析时,可能会同时研究多达100个基因,但是他猜测,为了方便起见,科学家们会将自己的研究范围限制在一次四五个基因。(生物谷 Bioon.com)
参考资料:
1.Ryan Muller et al. CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes. Science, 2020, doi:10.1126/science.abb9662.
2.Using CRISPR, new technique makes it easy to map genetic networks
https://phys.org/news/2020-12-crispr-technique-easy-genetic-networks.html
在一项新的研究中,来自美国加州大学伯克利分校的研究人员开发出一种简单的方法来做到这一点,它让任何人都可以对细胞(包括人类细胞)进行分析,并迅速确定基因组中所有调控特定基因表达的DNA序列。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes”。

CiBER-seq原理示意图,图片来自Science, 2020, doi:10.1126/science.abb9662。
虽然这项技术将主要受益于对影响感兴趣基因的遗传网络进行追踪的基础研究人员,它也将帮助人们快速找到控制疾病基因的调控序列,并可能找到新的药物靶点。
论文通讯作者、加州大学伯克利分校分子与细胞生物学副教授Nicholas Ingolia说,“你可能想要使用这种方法的疾病是癌症,在癌症中,我们知道癌细胞为了生存和生长而表达且是需要表达的某些基因。这个工具会让你问问题:上游基因是什么,哪些是我们知道的控制这些基因的调节因子?”
这些调节因子可能更容易通过药物加以靶向以关闭癌细胞。这种新技术简化了一些直到现在都很难做到的事情:沿着细胞中的遗传途径回溯,以找到这些最终的调节因子。
他说,“我们有很多向前工作的好方法。这是一种很好的逆向工作的方法,可用于弄清楚一些东西的上游是什么。我认为它在疾病研究方面有很多潜在的用途。”
他补充道,“我有时会打个比方,当我们走进一间黑暗的房间,按一下电灯开关,我们就能看到打开的是什么灯。这个灯就像一个基因,当我们按下开关,我们就能知道它开启了什么基因。我们已经在这方面做得很好了。这让我们可以做的是逆向工作。如果我们关注一个灯,我们想知道控制它的开关是什么。这给我们提供了一种方法来做到这一点。”
Ingolia实验室的研究生Ryan Muller及其同事Lucas Ferguson、Zuriah Meacham与Ingolia在Science期刊上发表了他们开发的这种技术的细节。
对基因组进行条码化处理
自从8年前CRISPR-Cas9基因编辑技术出现以来,想要确定某个特定基因功能的科学家们已经能够用Cas9蛋白精确地靶向该基因并将其敲除。在一段与该基因中的DNA互补的向导RNA(gRNA)的引导下,Cas9蛋白结合并切割该基因,或者像CRISPR干扰(CRISPRi)那样,抑制它。
在最简单的测试中,细胞或有机体要么生存,要么死亡。然而,可以寻找基因敲除的更微妙的影响,例如特定基因是否开启或关闭,或者它被调高或调低了多少。
如今,这需要添加一个报告基因--通常是一个编码绿色荧光蛋白的基因,所添加的报告基因连接到启动你感兴趣的基因表达的启动子的相同拷贝上。由于每个基因独特的启动子决定了该基因的表达时间,如果Cas9基因敲除影响了你感兴趣的基因的表达,也会影响报告基因的表达,使细胞培养物在荧光灯下发绿光。
尽管如此,酵母的全部基因有6000个--而人类的全部基因有2万个---要调整每个基因并发现对荧光报告基因的影响是一项大工程。
他说,“CRISPR使得全面调查基因组中的所有基因并对它们进行扰动变得很容易,但随后最大的问题是,你如何读出每个扰动的效果?”
这种新技术,Ingolia称之为CiBER-seq(CRISPR interference with barcoded expression reporter sequencing),解决了这个问题,通过让数万个CRISPR实验合并在一起,同时完成这些实验。该技术摒弃了荧光,采用深度测序的方式,直接测量合并样本(pooled sample)中基因活性的增加或减少。深度测序采用高通量、长读的新一代测序技术,对合并样本中表达的所有基因进行测序和基本计数。
Ingolia说,“在合并的CiBER-seq实验中,在一天之内,我们可以找到几个不同靶基因的所有上游调控因子,而如果你要使用基于荧光的技术,每一个靶基因都需要你花费多天的测量时间。”
对生物体内的每个基因进行平行CRISPR分析是很直接的,这要归功于那些出售现成的、与Cas9蛋白一起使用的单向导RNA(sgRNA)的公司。科学家们可以为基因组中的每个基因订购sgRNA,为每个基因可以订购十几种不同的sgRNA---大多数基因都是由数千个核苷酸组成的,而sgRNA的长度大约为20个核苷酸。
Ingolia团队的关键创新是将每个sgRNA与一个独特的、随机的核苷酸序列---本质上是一个条形码---连接到启动子上,只有当感兴趣的基因也被开启时,该启动子才会转录条形码序列。每个条形码可报告一个sgRNA的效果;在成千上万个sgRNA的复杂文库中,一个sgRNA靶向作用于一个基因。深度测序可以告诉你样品中每个条形码(对酵母而言,大约有6万个条形码)的相对丰度,让你快速评估酵母中6000个基因中的哪一个对启动子有影响,从而对感兴趣的基因的表达有影响。对于人类细胞来说,可能会插入20多万个不同的gRNA,多次靶向作用于每个基因。
他说,“这才是我们能够做到与众不同的关键:你有一个由不同的gRNA组成的大型文库,每一个gRNA都会扰动不同的基因,但它上面有同一个查询启动子(query promoter)--你正在研究的反应。这个查询启动子转录了我们链接到每个gRNA的随机条形码。如果存在一个你关心的反应,你就干扰一下基因组中的每个不同基因,看看这种反应是如何变化的。”
例如,如果你得到的一个条形码比其他任何一个条形码都要丰富10倍,那就告诉你该查询在细胞中被强烈开启了10倍的启动子。在实践中,Ingolia在每个gRNA上附加了大约四个不同的条形码,作为对结果的四重检查。
他说,“通过更直接地观察基因表达反应,我们可以发现很多微妙的生理学本身,细胞内部发生了什么。”
在这些新报道的实验中,Ingolia团队查询了酵母中的五个不同基因,包括参与新陈代谢、细胞分裂和细胞应激反应的基因。虽然在对整个基因组进行CRISPR分析时,可能会同时研究多达100个基因,但是他猜测,为了方便起见,科学家们会将自己的研究范围限制在一次四五个基因。(生物谷 Bioon.com)
参考资料:
1.Ryan Muller et al. CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes. Science, 2020, doi:10.1126/science.abb9662.
2.Using CRISPR, new technique makes it easy to map genetic networks
https://phys.org/news/2020-12-crispr-technique-easy-genetic-networks.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


