我国科学家又发表一篇Cell论文!详细剖析SARS-CoV-2刺突蛋白突变对病毒感染性和抗原性的影响
来源:本站原创 2020-07-26 07:50
2020年7月26日讯/生物谷BIOON/---COVID-19大流行在全球范围内是一个巨大的威胁。根据世界卫生组织(WHO)的统计,截至2020年7月3日,已有216个国家报告了COVID-19病例,确诊病例超过1000万,死亡人数约51.8万。作为COVID-19的病原体,SARS-CoV-2引起下呼吸道感染,可进展为严重的急性呼吸综合征,甚至多器官衰竭
2020年7月26日讯/生物谷BIOON/---COVID-19大流行在全球范围内是一个巨大的威胁。根据世界卫生组织(WHO)的统计,截至2020年7月3日,已有216个国家报告了COVID-19病例,确诊病例超过1000万,死亡人数约51.8万。作为COVID-19的病原体,SARS-CoV-2引起下呼吸道感染,可进展为严重的急性呼吸综合征,甚至多器官衰竭。
SARS-CoV-2是一种单股正链RNA病毒,其基因组编码4种结构蛋白:刺突蛋白(S)、小蛋白(E)、基质蛋白(M)和核衣壳蛋白(N)。S蛋白是一种I型融合蛋白,在病毒颗粒表面形成三聚体。它由S1和S2两个亚基组成:S1负责受体结合,S2负责膜融合。SARS-CoV-2利用血管紧张素转换酶2(ACE2)作为受体进入靶细胞。因此,S蛋白决定了这种病毒的感染性及其在宿主中的传播性。由于这种蛋白是诱导保护性免疫反应的主要抗原,所有正在开发的疫苗都针对它。显然,密切监测正在传播的病毒中S蛋白的抗原性变化是至关重要的。鉴于它是一种高度糖基化的蛋白,研究位点特异性聚糖(glycan)对感染性和免疫逃逸的影响也具有毋庸置疑的重要性。
已知RNA病毒的突变率高于DNA病毒。表面蛋白的氨基酸变化可以显著改变病毒功能和/或与中和抗体之间的相互作用。比如,基孔肯雅病毒E1蛋白发生的A226V突变促进了这种病毒在白纹伊蚊中的适应性,从而导致传播性增加。同样,埃博拉病毒GP蛋白发生的A82V突变导致病毒感染力和死亡率增加。此外,高致病性禽流感病毒H5N1的4个氨基酸变化表现出增强的传播性,而在H7N9病毒中,血凝素中A143V/R148K的组合氨基酸变化使得这种病毒对中和抗体的敏感性降低了10倍以上。
虽然SARS-CoV-2是最近才在人类中发现的,但是编码S蛋白的基因突变正在不断被报道。截至2020年5月6日,已在公共领域报道了329个S蛋白的天然变体。值得注意的是,只有13个氨基酸位点的突变率超过0.1%。初步研究提示着死亡率的增加可能与其中最主要的D614G突变有关。据推测,这种突变可能诱发了S蛋白的构象变化,从而导致感染力的增加。然而,这些报道的突变体是否会影响病毒的感染性、传播性或与中和抗体的反应性,基本上还不清楚。
另外,影响病毒蛋白糖基化的突变也是有据可查的,这些突变也会深刻影响病毒的生命周期及其与宿主的相互作用。比如,HIV-1 Env蛋白特定位点的N-糖基化对Env的表达和组装至关重要。某些糖基化位点的缺失可以降低Env蛋白与CD4受体的结合,从而破坏所产生的病毒颗粒的感染性。此外,糖基化位点突变也可使得病毒对抗体的中和作用产生抵抗性,而H5N1血凝素中某些糖基化位点的缺失已被发现会影响血凝素的切割、复制、稳定性和抗原性。值得注意的是,虽然SARS-CoV-2的S蛋白的糖基化程度更高,有22个潜在的N-糖基化位点,但是这些糖基化位点如何影响病毒感染力和抗体介导的中和作用仍是未知数。
在一项新的研究中,在一项新的研究中,来自中国食品药品检定研究院、北京协和医学院和清华大学的研究人员研究了SARS-CoV-2 S蛋白中发生氨基酸变化的天然变体以及在推定的N-连接糖基化位点上出现氨基酸变化的突变体(下称糖基化突变体)的生物学意义。为了实现这一点,他们构建出106种在公共领域报道的S蛋白突变体或在推定的N-连接糖基化位点上出现氨基酸变化的突变体,并使用高通量的假型病毒(pseudotyped virus)系统来分析它们的感染性和对中和抗体的反应性。他们报道,一些天然变体和糖基化突变体经进化后具有显著的感染性和抗原性变化。相关研究结果于2020年7月17日在线发表在Cell期刊上,论文标题为“The impact of mutations in SARS-CoV-2 spike on viral infectivity and antigenicity”。论文通讯作者为中国食品药品检定研究院的王佑春(Youchun Wang)博士和黄维金(Weijin Huang)博士。
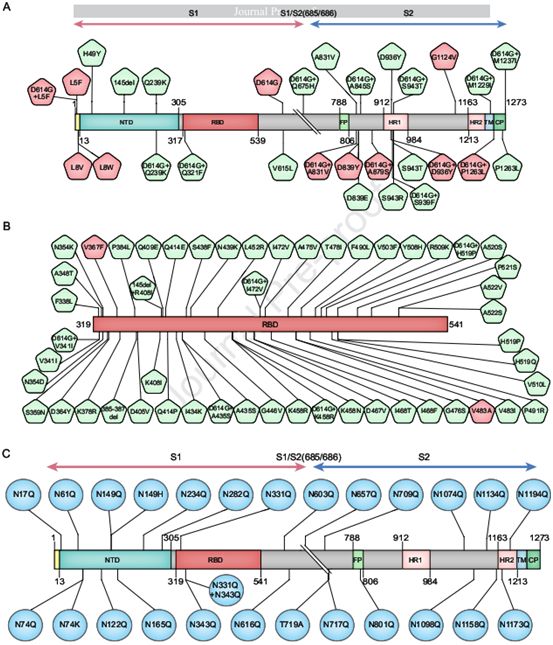
通过使用SARS-CoV-2毒株Wuhan-1(GenBank:MN908947)作为模板,这些作者选取了三组天然变体和糖基化突变体来构建假型病毒。如图1所示,A组代表了除受体结合结构域(RBD)区域之外的整个S基因(29种毒株)的所有高频变体和与D614G的组合变体。B组包括在RBD中出现的变体(51种毒株)。虽然A组和B组中的8种单点突变,即Q239K、V341I、A435S、K458R、I472V、H519P、A831V和S943T本身并不存在,但发现它们与D614G组合出现。因此,还构建了针对这8种单点突变的假型病毒,以便与针对它们和D614G的双位点组合突变构建的假型病毒进行比较。C组由在推定的糖基化位点(22个位点)中出现氨基酸变化的26种突变体组成,包括变体(N74K、N149H和T719A)和这些作者为分析对糖基化的影响而构建出的实验性突变体。具体来说,针对所有22个位点(N到Q)在实验室中构建出22种单点突变体;他们还进行了组合突变以移除RBD中的两个糖基化位点。总的来说,他们已经构建出106种假型病毒,即80种天然变体和26种糖基化突变体(图1)。
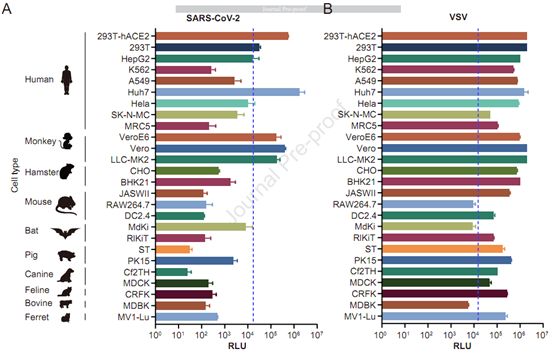
为了确定这些天然变体和糖基化突变体的感染性,这些作者最初利用携带SARS-CoV-2 S蛋白或VSV G蛋白的假型病毒感染26种细胞系。与预期的那样,这两种假型病毒在对这26种细胞系的感染性上存在差异(如图2所示)。不过,他们最终选择了四种细胞系---293T-hACE2、Huh-7、Vero 和LLC-MK2---开展实验。利用106种假型病毒感染这些细胞系,裂解受感染的细胞系,将获得的受感染细胞系的裂解液稀释10倍,并分析相应裂解液稀释后的发光值(RLU)。无论哪种假型病毒,当与参照毒株Wuhan-1的RLU值相差4倍时就被认为是显著的。
这些作者首先在293T-hACE2细胞系中测试这106种假型病毒的感染性,结果表明22种假型病毒被判定为低感染性(16种天然变体和6种糖基化突变体),RLU值下降4~100倍(图3A),其中13种假型病毒携带的突变位于RBD区域。天然变体V341I和实验性糖基化突变体(N331Q +N343Q)被视为无感染性,它们都位于RBD区域。值得注意的是,N331和N343位点上的双糖基化缺失导致病毒感染力急剧下降(1200倍),而单个位点的单糖基化缺失导致病毒感染力温和下降:N331Q的感染力仅下降3倍,N343Q的感染力下降20倍。此外,RBD的非自然双糖基化突变(N331Q和N343Q)导致感染力显著降低,这提示着RBD区域的这两个糖基化位点可能参与受体结合或维持这个区域的构象。

利用其他三个细胞系进一步测试了剩余的63种天然变体的感染性(图3B-3D)。值得注意的是,单点变体D614G以及与D614G的组合变体(D614G+L5F、D614G+V341I、D614G+K458R、D614G+I472V、D614G+D936Y、D614G+S939F和D614G+S943T)在所有4个细胞系中均表现出比参考毒株更高的感染力。而且单点变体D614G和与D614G的组合变体之间没有发现差异,这表明增强的感染性更可能归因于D614G本身。
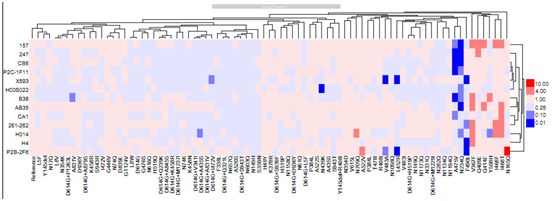
在确定了感染性发生变化的天然变体(下称感染性变体)后,这些作者接着利用13种中和单克隆抗体(mAb)着手研究这些感染性变体的抗原性。他们注意到,RBD区域的一些氨基酸变化表现出对中和mAb的敏感性发生改变(图4)。具体来说,A475V降低了对mAb 157、247、CB6、P2C-1F11、B38和CA1的敏感性,而F490L降低了对mAb X593、261-262、H4和P2B-2F6的敏感性。此外,V483A对mAb X593和P2B-2F6产生抵抗性,L452R对mAb X593和P2B-2F6产生抵抗性。最后,Y508H对mAb H014、N439K对mAb H00S022、A831V对mAb B38、D614G+I472V对mAb X593和D614G+A435S对mAb H014的敏感性降低了4倍以上。此外,观察到RBD区域的一些氨基酸变化,包括V367F、Q409E、Q414E、I468F、I468T、Y508H和A522V,更容易受到mAb介导的中和作用。
这些作者接下来确定感染性糖基化突变体如何对一系列相同的mAb作出反应。突变体N165Q实际上对mAb P2B-2F6变得更加敏感,而N234Q则降低了对包括mAb 157、247、CB6、P2C-1F11、H00S022、B38、AB35和H014在内的不同mAb的中和敏感性。这些结果证实了这两个糖基化位点对受体结合很重要。
这些作者证实,这些mAb在对氨基酸变化的分析中是有价值的。如图4所示,五种mAb,即mAb 157、247、CB6、P2C-1F11和B38,都不能有效中和A475V和N234Q。mAb X593和P2B-2F6均不能有效中和L452R、V483A和F490L,而mAb P2B-2F6更能有效中和N165Q。此外,mAb H014不能中和N234Q、Y508H和D614G+A435S,而mAb H4和261-262则不能中和F490L。此外,最后,mAb H00S022无法中和N439K和N234Q。
最后,这些作者测定了氨基酸发生变化的毒株对10份COVID-19患者恢复期血清的敏感性。没有一种天然变体和糖基化突变体对所有10份恢复期血清的敏感性发生显著改变,即与参考毒株相比,无论敏感性出现增加或减少,EC50值发生的变化没有超过4倍(图5A)。然而,发现F490L和H519P对其中的3份血清的中和敏感性均下降了4倍以上,而6种天然变体/糖基化突变体(N149H、N149Q、N165Q、N354D、N709Q和N1173Q)对这10份测试血清中的1或2份血清的敏感性增加了4倍以上。值得注意的是,这6种天然变体/糖基化突变体中有5种是聚糖缺失突变体。
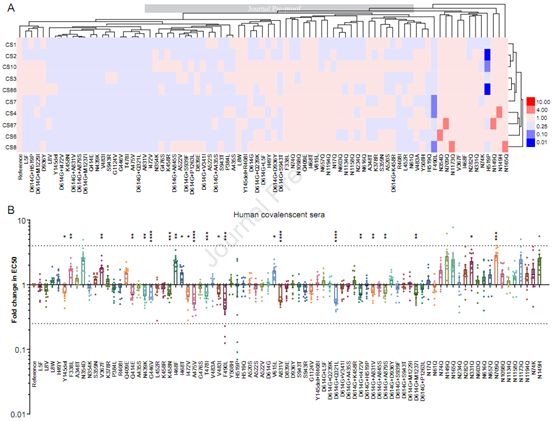
如图5B所示,当将每份恢复期血清的数据汇集在一起来分析所有天然变体的敏感性时,没有观察到明显的差异(>4倍)。然而,在一些天然变体和参考毒株之间观察到它们对分组恢复期血清的反应性存在适度差异(4倍以内)。这些差异具有统计学意义(P<0.05)。值得一提的是,与参考毒株相比,一些天然变体包括单点变体F338L、V367F、I468F、I468T和V615L(图5B)对恢复期血清更加敏感,而更多的天然变体对恢复期血清具有抵抗性。这些天然变体包括单个氨基酸变化,如Y145del、Q414E、N439K、G446V、K458N、I472V、A475V、T478I、V483I、F490L和A831V,以及双氨基酸变化,包括D614G+Q321L、D614G+I472V、D614G+A831V、D614G+A879S和D614G+M1237I。
与天然变体相类似的是,虽然一些糖基化缺失对恢复期血清的敏感性幅度小于4倍,但发现这些糖基化突变体与参考毒株株(Wuhan-1)的差异仍有数倍,且有统计学意义,即糖基化突变体N331Q和N709Q显著提高了对恢复期血清的敏感性(图5B)。
作为一种RNA病毒,SARS-CoV-2病毒预计将随着时间的推移在人类群体中继续进化。密切监测传播中的病毒毒株对病毒研究以及疫苗和药物的开发无疑具有重要意义。在这项研究中,这些作者分析了GISAID数据库中报告的所有S蛋白序列(超过13000个)。在过滤掉不完整、冗余和模糊的序列后,他们将范围缩小到80种天然变体。此外,由于病毒蛋白的糖基化已被发现会影响病毒复制和免疫反应,而SARS-CoV-2 S蛋白的糖基化程度很高,他们还在所有22个假定的糖基化位点上进行了26种替代突变。他们总共构建出106种假型病毒,从而使得能够使用现有的方法对它们进行表征。
表1总结了天然变体和实验性糖基化突变体的特征。在所有天然变体中,D614G特别值得注意。该天然变体自出现以来迅速积累,并与更多的临床表现有关。在这项研究开始时(2020年5月6日),它占所有传播毒株的62.8%,但到7月3日,它已达到75.7%。这种优势毒株可以有效感染测试的4种细胞系,比参考Wuhan-1毒株的感染力高10倍(图3)。
综上所述,这些作者分析了100多种假型病毒的感染性和它们对得到很好研究的mAb或COVID-19患者恢复期血清的中和作用的敏感性。在整个S蛋白中都观察到了氨基酸变化。他们发现在S蛋白除RBD之外的区域中发现的一种单位点氨基酸变化(D614G)具有更强的感染力,但没有证据表明它对中和抗体具有抵抗性。然而,尤其值得注意的是D614G日益增长的优势。虽然这项研究中分析的一些在RBD区域出现氨基酸变化的毒株失去了感染力而表明它们可能不会广泛流行,但是对抗体介导的中和作用的抵抗性出现增加的RBD天然变体应密切关注。此外,糖基化位点的缺失影响了它们对中和抗体的反应性,同时也影响了它们的感染性,这就强化了聚糖可以实质性影响SARS-CoV-2病毒复制和疫苗诱导的免疫反应的概念。总的来说,这些研究结果有助于阐明在人群体中传播的病毒的一些不断进化的毒株对感染力增强和抗原性变化的影响。(生物谷 Bioon.com)
参考资料:
Qianqian Li et al. The impact of mutations in SARS-CoV-2 spike on viral infectivity and antigenicity. Cell, 2020, doi:10.1016/j.cell.2020.07.012.
SARS-CoV-2是一种单股正链RNA病毒,其基因组编码4种结构蛋白:刺突蛋白(S)、小蛋白(E)、基质蛋白(M)和核衣壳蛋白(N)。S蛋白是一种I型融合蛋白,在病毒颗粒表面形成三聚体。它由S1和S2两个亚基组成:S1负责受体结合,S2负责膜融合。SARS-CoV-2利用血管紧张素转换酶2(ACE2)作为受体进入靶细胞。因此,S蛋白决定了这种病毒的感染性及其在宿主中的传播性。由于这种蛋白是诱导保护性免疫反应的主要抗原,所有正在开发的疫苗都针对它。显然,密切监测正在传播的病毒中S蛋白的抗原性变化是至关重要的。鉴于它是一种高度糖基化的蛋白,研究位点特异性聚糖(glycan)对感染性和免疫逃逸的影响也具有毋庸置疑的重要性。
已知RNA病毒的突变率高于DNA病毒。表面蛋白的氨基酸变化可以显著改变病毒功能和/或与中和抗体之间的相互作用。比如,基孔肯雅病毒E1蛋白发生的A226V突变促进了这种病毒在白纹伊蚊中的适应性,从而导致传播性增加。同样,埃博拉病毒GP蛋白发生的A82V突变导致病毒感染力和死亡率增加。此外,高致病性禽流感病毒H5N1的4个氨基酸变化表现出增强的传播性,而在H7N9病毒中,血凝素中A143V/R148K的组合氨基酸变化使得这种病毒对中和抗体的敏感性降低了10倍以上。
虽然SARS-CoV-2是最近才在人类中发现的,但是编码S蛋白的基因突变正在不断被报道。截至2020年5月6日,已在公共领域报道了329个S蛋白的天然变体。值得注意的是,只有13个氨基酸位点的突变率超过0.1%。初步研究提示着死亡率的增加可能与其中最主要的D614G突变有关。据推测,这种突变可能诱发了S蛋白的构象变化,从而导致感染力的增加。然而,这些报道的突变体是否会影响病毒的感染性、传播性或与中和抗体的反应性,基本上还不清楚。
另外,影响病毒蛋白糖基化的突变也是有据可查的,这些突变也会深刻影响病毒的生命周期及其与宿主的相互作用。比如,HIV-1 Env蛋白特定位点的N-糖基化对Env的表达和组装至关重要。某些糖基化位点的缺失可以降低Env蛋白与CD4受体的结合,从而破坏所产生的病毒颗粒的感染性。此外,糖基化位点突变也可使得病毒对抗体的中和作用产生抵抗性,而H5N1血凝素中某些糖基化位点的缺失已被发现会影响血凝素的切割、复制、稳定性和抗原性。值得注意的是,虽然SARS-CoV-2的S蛋白的糖基化程度更高,有22个潜在的N-糖基化位点,但是这些糖基化位点如何影响病毒感染力和抗体介导的中和作用仍是未知数。
在一项新的研究中,在一项新的研究中,来自中国食品药品检定研究院、北京协和医学院和清华大学的研究人员研究了SARS-CoV-2 S蛋白中发生氨基酸变化的天然变体以及在推定的N-连接糖基化位点上出现氨基酸变化的突变体(下称糖基化突变体)的生物学意义。为了实现这一点,他们构建出106种在公共领域报道的S蛋白突变体或在推定的N-连接糖基化位点上出现氨基酸变化的突变体,并使用高通量的假型病毒(pseudotyped virus)系统来分析它们的感染性和对中和抗体的反应性。他们报道,一些天然变体和糖基化突变体经进化后具有显著的感染性和抗原性变化。相关研究结果于2020年7月17日在线发表在Cell期刊上,论文标题为“The impact of mutations in SARS-CoV-2 spike on viral infectivity and antigenicity”。论文通讯作者为中国食品药品检定研究院的王佑春(Youchun Wang)博士和黄维金(Weijin Huang)博士。

图1.为这项研究选择的氨基酸变化说明,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
通过使用SARS-CoV-2毒株Wuhan-1(GenBank:MN908947)作为模板,这些作者选取了三组天然变体和糖基化突变体来构建假型病毒。如图1所示,A组代表了除受体结合结构域(RBD)区域之外的整个S基因(29种毒株)的所有高频变体和与D614G的组合变体。B组包括在RBD中出现的变体(51种毒株)。虽然A组和B组中的8种单点突变,即Q239K、V341I、A435S、K458R、I472V、H519P、A831V和S943T本身并不存在,但发现它们与D614G组合出现。因此,还构建了针对这8种单点突变的假型病毒,以便与针对它们和D614G的双位点组合突变构建的假型病毒进行比较。C组由在推定的糖基化位点(22个位点)中出现氨基酸变化的26种突变体组成,包括变体(N74K、N149H和T719A)和这些作者为分析对糖基化的影响而构建出的实验性突变体。具体来说,针对所有22个位点(N到Q)在实验室中构建出22种单点突变体;他们还进行了组合突变以移除RBD中的两个糖基化位点。总的来说,他们已经构建出106种假型病毒,即80种天然变体和26种糖基化突变体(图1)。
为了确定这些天然变体和糖基化突变体的感染性,这些作者最初利用携带SARS-CoV-2 S蛋白或VSV G蛋白的假型病毒感染26种细胞系。与预期的那样,这两种假型病毒在对这26种细胞系的感染性上存在差异(如图2所示)。不过,他们最终选择了四种细胞系---293T-hACE2、Huh-7、Vero 和LLC-MK2---开展实验。利用106种假型病毒感染这些细胞系,裂解受感染的细胞系,将获得的受感染细胞系的裂解液稀释10倍,并分析相应裂解液稀释后的发光值(RLU)。无论哪种假型病毒,当与参照毒株Wuhan-1的RLU值相差4倍时就被认为是显著的。

图2.对易感细胞系的选择,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
这些作者首先在293T-hACE2细胞系中测试这106种假型病毒的感染性,结果表明22种假型病毒被判定为低感染性(16种天然变体和6种糖基化突变体),RLU值下降4~100倍(图3A),其中13种假型病毒携带的突变位于RBD区域。天然变体V341I和实验性糖基化突变体(N331Q +N343Q)被视为无感染性,它们都位于RBD区域。值得注意的是,N331和N343位点上的双糖基化缺失导致病毒感染力急剧下降(1200倍),而单个位点的单糖基化缺失导致病毒感染力温和下降:N331Q的感染力仅下降3倍,N343Q的感染力下降20倍。此外,RBD的非自然双糖基化突变(N331Q和N343Q)导致感染力显著降低,这提示着RBD区域的这两个糖基化位点可能参与受体结合或维持这个区域的构象。

图3.对天然变体和糖基化位点缺失突变的感染性分析,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
利用其他三个细胞系进一步测试了剩余的63种天然变体的感染性(图3B-3D)。值得注意的是,单点变体D614G以及与D614G的组合变体(D614G+L5F、D614G+V341I、D614G+K458R、D614G+I472V、D614G+D936Y、D614G+S939F和D614G+S943T)在所有4个细胞系中均表现出比参考毒株更高的感染力。而且单点变体D614G和与D614G的组合变体之间没有发现差异,这表明增强的感染性更可能归因于D614G本身。
在确定了感染性发生变化的天然变体(下称感染性变体)后,这些作者接着利用13种中和单克隆抗体(mAb)着手研究这些感染性变体的抗原性。他们注意到,RBD区域的一些氨基酸变化表现出对中和mAb的敏感性发生改变(图4)。具体来说,A475V降低了对mAb 157、247、CB6、P2C-1F11、B38和CA1的敏感性,而F490L降低了对mAb X593、261-262、H4和P2B-2F6的敏感性。此外,V483A对mAb X593和P2B-2F6产生抵抗性,L452R对mAb X593和P2B-2F6产生抵抗性。最后,Y508H对mAb H014、N439K对mAb H00S022、A831V对mAb B38、D614G+I472V对mAb X593和D614G+A435S对mAb H014的敏感性降低了4倍以上。此外,观察到RBD区域的一些氨基酸变化,包括V367F、Q409E、Q414E、I468F、I468T、Y508H和A522V,更容易受到mAb介导的中和作用。

图4.用一组中和单克隆抗体分析天然变体和实验性糖基化突变体的抗原性,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
这些作者接下来确定感染性糖基化突变体如何对一系列相同的mAb作出反应。突变体N165Q实际上对mAb P2B-2F6变得更加敏感,而N234Q则降低了对包括mAb 157、247、CB6、P2C-1F11、H00S022、B38、AB35和H014在内的不同mAb的中和敏感性。这些结果证实了这两个糖基化位点对受体结合很重要。
这些作者证实,这些mAb在对氨基酸变化的分析中是有价值的。如图4所示,五种mAb,即mAb 157、247、CB6、P2C-1F11和B38,都不能有效中和A475V和N234Q。mAb X593和P2B-2F6均不能有效中和L452R、V483A和F490L,而mAb P2B-2F6更能有效中和N165Q。此外,mAb H014不能中和N234Q、Y508H和D614G+A435S,而mAb H4和261-262则不能中和F490L。此外,最后,mAb H00S022无法中和N439K和N234Q。
最后,这些作者测定了氨基酸发生变化的毒株对10份COVID-19患者恢复期血清的敏感性。没有一种天然变体和糖基化突变体对所有10份恢复期血清的敏感性发生显著改变,即与参考毒株相比,无论敏感性出现增加或减少,EC50值发生的变化没有超过4倍(图5A)。然而,发现F490L和H519P对其中的3份血清的中和敏感性均下降了4倍以上,而6种天然变体/糖基化突变体(N149H、N149Q、N165Q、N354D、N709Q和N1173Q)对这10份测试血清中的1或2份血清的敏感性增加了4倍以上。值得注意的是,这6种天然变体/糖基化突变体中有5种是聚糖缺失突变体。

图5.天然变体和实验性糖基化突变体对一组恢复期血清样本的不同敏感性,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
如图5B所示,当将每份恢复期血清的数据汇集在一起来分析所有天然变体的敏感性时,没有观察到明显的差异(>4倍)。然而,在一些天然变体和参考毒株之间观察到它们对分组恢复期血清的反应性存在适度差异(4倍以内)。这些差异具有统计学意义(P<0.05)。值得一提的是,与参考毒株相比,一些天然变体包括单点变体F338L、V367F、I468F、I468T和V615L(图5B)对恢复期血清更加敏感,而更多的天然变体对恢复期血清具有抵抗性。这些天然变体包括单个氨基酸变化,如Y145del、Q414E、N439K、G446V、K458N、I472V、A475V、T478I、V483I、F490L和A831V,以及双氨基酸变化,包括D614G+Q321L、D614G+I472V、D614G+A831V、D614G+A879S和D614G+M1237I。
与天然变体相类似的是,虽然一些糖基化缺失对恢复期血清的敏感性幅度小于4倍,但发现这些糖基化突变体与参考毒株株(Wuhan-1)的差异仍有数倍,且有统计学意义,即糖基化突变体N331Q和N709Q显著提高了对恢复期血清的敏感性(图5B)。
作为一种RNA病毒,SARS-CoV-2病毒预计将随着时间的推移在人类群体中继续进化。密切监测传播中的病毒毒株对病毒研究以及疫苗和药物的开发无疑具有重要意义。在这项研究中,这些作者分析了GISAID数据库中报告的所有S蛋白序列(超过13000个)。在过滤掉不完整、冗余和模糊的序列后,他们将范围缩小到80种天然变体。此外,由于病毒蛋白的糖基化已被发现会影响病毒复制和免疫反应,而SARS-CoV-2 S蛋白的糖基化程度很高,他们还在所有22个假定的糖基化位点上进行了26种替代突变。他们总共构建出106种假型病毒,从而使得能够使用现有的方法对它们进行表征。
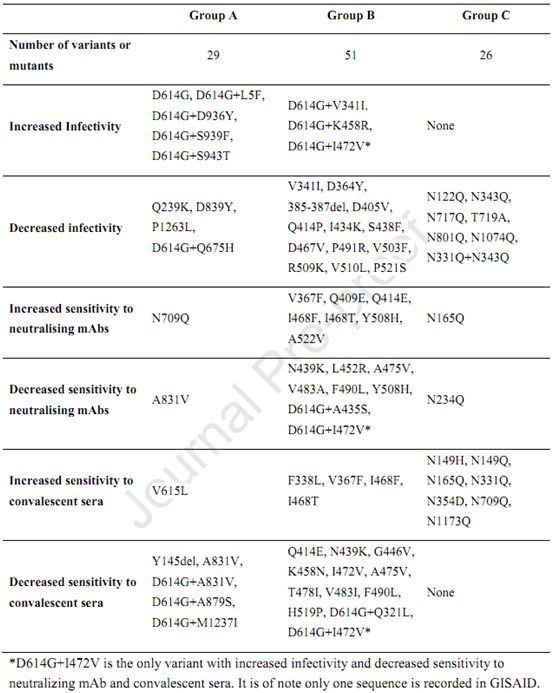
表1总结了天然变体和实验性糖基化突变体的特征。在所有天然变体中,D614G特别值得注意。该天然变体自出现以来迅速积累,并与更多的临床表现有关。在这项研究开始时(2020年5月6日),它占所有传播毒株的62.8%,但到7月3日,它已达到75.7%。这种优势毒株可以有效感染测试的4种细胞系,比参考Wuhan-1毒株的感染力高10倍(图3)。

表1.天然变体和糖基化突变体的特征,图片来自Cell, 2020, doi:10.1016/j.cell.2020.07.012。
综上所述,这些作者分析了100多种假型病毒的感染性和它们对得到很好研究的mAb或COVID-19患者恢复期血清的中和作用的敏感性。在整个S蛋白中都观察到了氨基酸变化。他们发现在S蛋白除RBD之外的区域中发现的一种单位点氨基酸变化(D614G)具有更强的感染力,但没有证据表明它对中和抗体具有抵抗性。然而,尤其值得注意的是D614G日益增长的优势。虽然这项研究中分析的一些在RBD区域出现氨基酸变化的毒株失去了感染力而表明它们可能不会广泛流行,但是对抗体介导的中和作用的抵抗性出现增加的RBD天然变体应密切关注。此外,糖基化位点的缺失影响了它们对中和抗体的反应性,同时也影响了它们的感染性,这就强化了聚糖可以实质性影响SARS-CoV-2病毒复制和疫苗诱导的免疫反应的概念。总的来说,这些研究结果有助于阐明在人群体中传播的病毒的一些不断进化的毒株对感染力增强和抗原性变化的影响。(生物谷 Bioon.com)
参考资料:
Qianqian Li et al. The impact of mutations in SARS-CoV-2 spike on viral infectivity and antigenicity. Cell, 2020, doi:10.1016/j.cell.2020.07.012.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


