Science:重大进展!揭示肿瘤起始细胞通过IL-33/TGF-β壁龛信号循环促进肿瘤进展
来源:本站原创 2020-07-19 08:17
2020年7月19日讯/生物谷BIOON/---一小部分具有长期致瘤能力的肿瘤细胞,即肿瘤起始细胞(tumor-initiating cell, TIC),在癌症的发展和治疗抵抗性中起着关键作用。然而,由于缺乏对TIC脆弱性的识别,有效的TIC靶向疗法的开发进展受限。正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其
2020年7月19日讯/生物谷BIOON/---一小部分具有长期致瘤能力的肿瘤细胞,即肿瘤起始细胞(tumor-initiating cell, TIC),在癌症的发展和治疗抵抗性中起着关键作用。然而,由于缺乏对TIC脆弱性的识别,有效的TIC靶向疗法的开发进展受限。
正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其后代的恶性表型(malignant phenotype)受到来自TIC相关肿瘤微环境(即所谓的TIC壁龛)的各种因素控制。因此,从机制上理解TIC和TIC壁龛(TIC niche)之间的相互作用,可以加速持久性癌症治疗药物的开发。
虽然TIC壁龛被认为是通过与TIC的双向互动而演化的,但是在肿瘤发展过程中,TIC-TIC壁龛相互作用的机制却不甚明了。已知实体瘤在基质中招募免疫细胞,为它们的生长和生存创造有利条件。然而,人们对于TIC如何调控TIC支持性免疫细胞在它们的空间附近的定位和功能还知之甚少。
利用鳞状细胞癌(SCC)的小鼠模型,来自美国俄勒冈健康与科学大学的研究人员之前已发现转化生长因子β(TGF-β)可诱导一部分耐药的TIC出现,从而产生浸润性、分化不良的后代。他们观察到,这些TGF-β反应性的肿瘤细胞在空间上与邻近基质中的局部TGF-β表达相关。因此,导致“富含TGF-β”的肿瘤微环境的机制可能是TIC-TIC壁龛相互作用出现的基础,并有可能被用来作为破坏TIC稳定的新靶点。
鉴于正常干细胞通过发送短距离信号来协调它们的壁龛,这些研究人员假设TIC可能会向邻近基质发送特定的信号分子,以诱导TIC支持性壁龛。
在一项新的研究中,通过着重关注TGF-β反应性TIC附近的细胞因子环境(cytokine milieu)和免疫细胞,这些研究人员确定了TIC如何产生一种空间上独特的壁龛微环境,这是SCC的浸润性进展和耐药性所必需的。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression”。
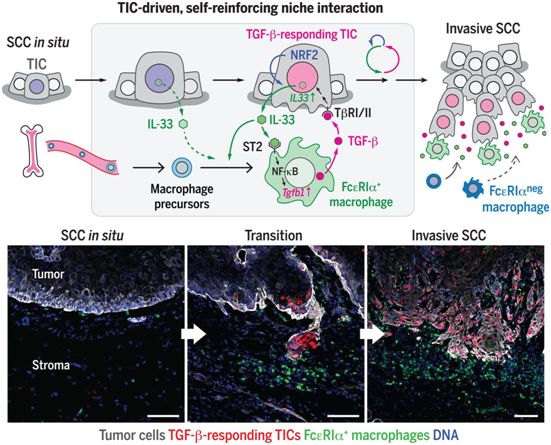
在寻找邻近肿瘤微环境的潜在旁分泌调节剂时,他们发现白细胞介素-33(IL-33)是TGF-β反应性TIC中上调最高的细胞因子。鉴于IL-33在正常情况下储存在细胞核中,他们发现它在NRF2介导的抗氧化反应中被释放到细胞外空间,这是TGF-β反应性TIC的标志。这种源自TIC的IL-33是SCC的浸润性进展和耐药性所必需的。
从机制上讲,IL-33诱导一部分表达IL-33受体ST2和高亲和力IgE受体(FcεRIα)的肿瘤相关巨噬细胞亚群在接近TIC的地方(即半径50μm内)堆积。这些以前未被重视的FcεRIα+巨噬细胞从骨髓源细胞中分化并交替激活,通过IL-33-ST2-NF-κB通路构建出一种富含TGF-β的壁龛微环境,从而诱导TGF-β信号旁分泌到TIC,并进一步上调IL-33的表达。阻断该通路或清除FcεRIα+巨噬细胞,都可减少TGF-β反应性TIC数量,降低浸润性肿瘤进展速度和化疗耐药性。
治疗抵抗性的TIC被认为是癌症治疗失败的主要元凶。通过研究小鼠模型,这些研究人员揭示了TIC壁龛形成的细胞和分子基础,其中TIC壁龛促进SCC恶性进展和出现耐药性。他们发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环,这为自我强化TIC-TIC壁龛相互作用提供了机制上的新见解。这种相互作用可能是破坏TIC稳定以提高癌症治疗效果的潜在靶标。(生物谷 Bioon.com)
参考资料:
Sachiko Taniguchi et al. Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression. Science, 2020, doi:10.1126/science.aay1813.
正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其后代的恶性表型(malignant phenotype)受到来自TIC相关肿瘤微环境(即所谓的TIC壁龛)的各种因素控制。因此,从机制上理解TIC和TIC壁龛(TIC niche)之间的相互作用,可以加速持久性癌症治疗药物的开发。
虽然TIC壁龛被认为是通过与TIC的双向互动而演化的,但是在肿瘤发展过程中,TIC-TIC壁龛相互作用的机制却不甚明了。已知实体瘤在基质中招募免疫细胞,为它们的生长和生存创造有利条件。然而,人们对于TIC如何调控TIC支持性免疫细胞在它们的空间附近的定位和功能还知之甚少。
利用鳞状细胞癌(SCC)的小鼠模型,来自美国俄勒冈健康与科学大学的研究人员之前已发现转化生长因子β(TGF-β)可诱导一部分耐药的TIC出现,从而产生浸润性、分化不良的后代。他们观察到,这些TGF-β反应性的肿瘤细胞在空间上与邻近基质中的局部TGF-β表达相关。因此,导致“富含TGF-β”的肿瘤微环境的机制可能是TIC-TIC壁龛相互作用出现的基础,并有可能被用来作为破坏TIC稳定的新靶点。
鉴于正常干细胞通过发送短距离信号来协调它们的壁龛,这些研究人员假设TIC可能会向邻近基质发送特定的信号分子,以诱导TIC支持性壁龛。
在一项新的研究中,通过着重关注TGF-β反应性TIC附近的细胞因子环境(cytokine milieu)和免疫细胞,这些研究人员确定了TIC如何产生一种空间上独特的壁龛微环境,这是SCC的浸润性进展和耐药性所必需的。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression”。

促进小鼠癌症进展的IL-33-TGF-β壁龛信号循环。图片来自Science, 2020, doi:10.1126/science.aay1813。
在寻找邻近肿瘤微环境的潜在旁分泌调节剂时,他们发现白细胞介素-33(IL-33)是TGF-β反应性TIC中上调最高的细胞因子。鉴于IL-33在正常情况下储存在细胞核中,他们发现它在NRF2介导的抗氧化反应中被释放到细胞外空间,这是TGF-β反应性TIC的标志。这种源自TIC的IL-33是SCC的浸润性进展和耐药性所必需的。
从机制上讲,IL-33诱导一部分表达IL-33受体ST2和高亲和力IgE受体(FcεRIα)的肿瘤相关巨噬细胞亚群在接近TIC的地方(即半径50μm内)堆积。这些以前未被重视的FcεRIα+巨噬细胞从骨髓源细胞中分化并交替激活,通过IL-33-ST2-NF-κB通路构建出一种富含TGF-β的壁龛微环境,从而诱导TGF-β信号旁分泌到TIC,并进一步上调IL-33的表达。阻断该通路或清除FcεRIα+巨噬细胞,都可减少TGF-β反应性TIC数量,降低浸润性肿瘤进展速度和化疗耐药性。
治疗抵抗性的TIC被认为是癌症治疗失败的主要元凶。通过研究小鼠模型,这些研究人员揭示了TIC壁龛形成的细胞和分子基础,其中TIC壁龛促进SCC恶性进展和出现耐药性。他们发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环,这为自我强化TIC-TIC壁龛相互作用提供了机制上的新见解。这种相互作用可能是破坏TIC稳定以提高癌症治疗效果的潜在靶标。(生物谷 Bioon.com)
参考资料:
Sachiko Taniguchi et al. Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression. Science, 2020, doi:10.1126/science.aay1813.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


