新型抗炎药!赛诺菲/再生元Dupixent在美国获批:治疗6-11岁儿童中重度特应性皮炎的生物药!
来源:本站原创 2020-05-27 15:02
2020年05月27日讯 /生物谷BIOON/ --赛诺菲(Sanofi)与再生元(Regeneron)近日联合宣布,美国食品和药物管理局(FDA)已批准Dupixent(dupilumab),用于治疗6-11岁中度至重度特应性皮炎(AD)儿童患者。该适应症通过优先审查程序获得批准,之前,FDA已授予Dupixent治疗采用外用处方药控制不佳的6个月-11岁

2020年05月27日讯 /生物谷BIOON/ --赛诺菲(Sanofi)与再生元(Regeneron)近日联合宣布,美国食品和药物管理局(FDA)已批准Dupixent(dupilumab),用于治疗6-11岁中度至重度特应性皮炎(AD)儿童患者。该适应症通过优先审查程序获得批准,之前,FDA已授予Dupixent治疗采用外用处方药控制不佳的6个月-11岁儿童重度AD的突破性药物资格(BTD)。
值得一提的是,Dupixent是唯一被批准用于6-11岁中重度AD儿童群体的生物制剂,该药具体适应症为:作为一种附加维持疗法,用于采用外用处方疗法未能充分控制疾病或当这些疗法不可取的6-11岁儿童患者治疗中度至重度AD。
Dupixent是一种皮下注射制剂,在儿科(6-11岁)AD患者中有2种剂量方案,根据体重处方(在初始负荷剂量后,对于体重≥15公斤至<30公斤的儿童剂量为每4周一次300mg,对于体重≥30公斤至<60公斤的儿童剂量为每2周一次200mg)。
Dupixent是一种全人源化单克隆抗体,可抑制IL-4和IL-13的信号传导,该药不是一种免疫抑制剂。来自Dupixent临床试验的数据表明,IL-4/IL-13是2型炎症的关键驱动因素,在特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉病(CRSwNP)中起着关键作用。在全球已批准的这3个适应症中,超过15万患者接受了Dupixent治疗。
再生元联合创始人、总裁兼首席科学官George D. Yancopoulos博士表示:“这一批准将为中重度特应性皮炎儿童带来一种改变模式的疗效和安全性。这些年轻、脆弱的群体正在与致衰性的症状做斗争。我们将继续研究Dupixent在6个月至5岁的中重度特应性皮炎儿童和哮喘儿童中的应用潜力。此外,我们正在调查治疗由2型炎症引起的其他疾病,包括嗜酸性食管炎、食物和环境过敏、慢性阻塞性肺病和其他皮肤病。”
赛诺菲全球研发主管John Reed医学博表示:“这项FDA批准是Dupixent作为一种创新生物疗法在治疗特应性皮炎和部分由2型炎症引起的其他疾病的过程中的另一个里程碑。中重度特应性皮炎患儿的护理人员和他们的医生现在可以使用一种经证实安全的一流生物制剂,安全因素通常在较年轻患者的治疗决策中起着关键作用。此外,Dupixent在第一次给药后的2周内就观察到瘙痒和疾病严重程度的改善,并在整个积极治疗期间继续观察到,这对这些儿童及其家庭都很重要。”
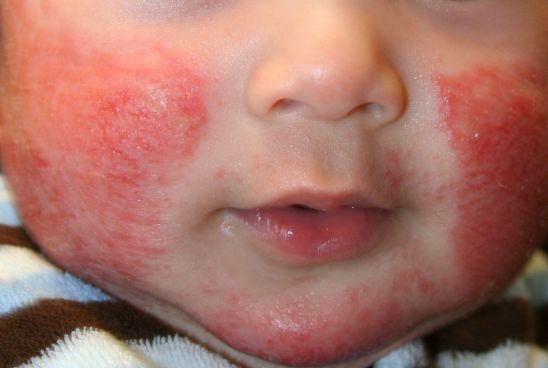
此次批准,基于一项关键性Dupixent 儿科III期临床研究(NCT03345914)的结果。这是一项随机、双盲、安慰剂对照研究,评估了Dupixent联合标准护理局部皮质类固醇(TCS)治疗儿童重度AD(平均覆盖近60%皮肤表面)的疗效和安全性。研究共入组367例病情不能通过局部药物充分控制的6-11岁重度AD患者。总的来说,有92%的患者同时患有至少一种并发疾病,如过敏性鼻炎、哮喘和食物过敏。
在整个研究过程中,所有患者都接受TCS治疗。这些患者随机进入三个治疗组,接受为期16周治疗:第一组接受Dupixent每4周一次皮下注射300mg(初始剂量600mg);第二组接受Dupixent每2周一次皮下注射100mg或200mg(基于体重调整,<30公斤剂量为100mg,≥30公斤剂量为200mg),初始剂量分别为200mg或400mg;第三组接受每2周或每4周一次皮下注射安慰剂。主要终点是在16周内达到研究者总体评估(IGA)评分为0(清除)或1(几乎清除)以及湿疹严重程度指数改善75%(EASI-75,美国以外的共同主要终点)的患者比例。
结果显示,该研究达到了主要终点和次要终点。数据显示,在重度AD儿童患者中,与TCS相比,Dupixent联合TCS显著改善了整体疾病严重程度、皮肤清除、瘙痒、健康相关生活质量的测定结果。此外,安全性数据与先前在12岁及以上患者群体中记录到的安全性数据一致,包括与安慰剂相比皮肤感染率在数值上较低。
16周治疗结果包括:(1)第一组和第二组分别有33%、30%的患者皮损达到IGA评分为0(清除)或1(几乎清除),安慰剂组为11%(分别为:p<0.0001和p=0.0004)。(2)第一组和第二组分别有70%、67%的患者达到75%或更高的皮肤改善(EASI-75),安慰剂组为27%(均p<0.0001)。(3)第一组和第二组平均EASI评分相对基线改善82%、78%,安慰剂组为49%(均p<0.0001)。(4)Dupixent显示出明显的瘙痒缓解,并改善了患者报告结果的测量,如焦虑、抑郁、父母和家庭成员的健康相关生活质量。
16周治疗期间,第一组和第二组不良事件总发生率为65%、67%,安慰剂组为73%。Dupixent治疗更常见的不良事件包括结膜炎(第一组7%、第二组15%、安慰剂组4%)、鼻咽炎(第一组13%、第二组7%、安慰剂组7%)、注射部位反应(第一组10%、第二组11%、安慰剂组6%)。其他预先指定的不良事件包括:皮肤感染(第一组6%、第二组8%、安慰剂组13%)、疱疹病毒感染(第一组2%、第二组3%、安慰剂组5%)。
根据该结果,Dupixent是首个在这一儿科(6-11岁)AD群体中显示出积极结果的生物制剂。
Dupixent靶向2型炎症的关键驱动因素,该药是一种全人源化单克隆抗体,特异性抑制2种关键蛋白IL-4和IL-13的过度激活信号。IL-4/IL-13是2种炎症因子,据认为是过敏性疾病和其他2型炎症疾病中内在炎症的关键驱动因素,包括特应性皮炎、哮喘、嗜酸细胞性食管炎、草过敏、花生过敏等。
Dupixent于2017年3月底上市成为全球首个治疗中重度特应性皮炎的生物制剂。截至目前,该药已获多个国家和地区批准,包括美国、欧盟和日本。在美国,Dupixent现在被批准治疗3种由2型炎症导致的疾病:中度至重度特应性皮炎(≥6岁患者)、中度至重度哮喘(≥12岁患者)、伴鼻息肉的慢性鼻-鼻窦炎(CRSwNP,成人患者)。
目前,赛诺菲和再生元也正在开展一项广泛的临床项目,评估Dupixent治疗由过敏和其他2型炎症引起的疾病,包括:儿童哮喘(6-11岁,III期)、儿童特应性皮炎(6个月至5岁,II/III期)、嗜酸性食管炎(III期)、慢性阻塞性肺病(III期)、大疱性类天疱疮(III期) 、结节性痒疹(III期)、慢性自发性荨麻疹(III期)、食物和环境过敏(II期)。
Dupixent是赛诺菲与再生元继PCSK9抑制剂类降脂药Praluent之后合作开发的另一个重要产品,有望成为一款改变游戏规则的药物。目前,Dupixent适应症正在稳步增加,知名医药市场调研机构EvaluatePharma之前预测,该药在2024年的全球销售额或将达到80亿美元。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


