Science:内质网自噬让细胞保持健康
来源:本站原创 2019-07-14 17:47
2019年7月14日讯/生物谷BIOON/---未折叠蛋白反应(UPR)通过包括内质网相关性降解(ER-associated degradation, ERAD)在内的多种机制维持内质网稳态。ERAD识别末端错误折叠或未组装的蛋白,并让它们跨过内质网膜逆向转位到细胞质中,在那里它们被蛋白酶体降解。然而,某些与疾病相关的易聚集的蛋白(下称易聚集蛋白)不能被ERAD清除,但可通过其他途径处理掉。易聚集
2019年7月14日讯/生物谷BIOON/---未折叠蛋白反应(UPR)通过包括内质网相关性降解(ER-associated degradation, ERAD)在内的多种机制维持内质网稳态。ERAD识别末端错误折叠或未组装的蛋白,并让它们跨过内质网膜逆向转位到细胞质中,在那里它们被蛋白酶体降解。然而,某些与疾病相关的易聚集的蛋白(下称易聚集蛋白)不能被ERAD清除,但可通过其他途径处理掉。易聚集蛋白与多种神经退行性疾病有关,包括以遗传性痉挛性截瘫为特征的多种疾病。因此,了解这些替代性处理途径如何发挥作用具有重要的医学意义。
作为一种替代性处理途径,内质网自噬(ER-phagy)靶向易聚集蛋白位于内质网中的结构域(即内质网结构域)并将它们押送到自噬体中以便将它们递送至液泡或溶酶体中进行降解。当诱导内质网自噬时,内质网自噬受体将它们的结合伴侣---酵母中的Atg8或哺乳动物中的LC3---招募到内质网的离散位点上,从而促进自噬体形成。这些位点形成于高度动态的由Lnp1加以稳定的管状内质网网络上,其中Lnp1是一种位于管状内质网连接处的保守蛋白。尽管内质网自噬发生在连续内质网网络的离散位点上,但是将内质网装载到自噬体中的受体分散于这个内质网网络中。内质网上的特定位点如何成为内质网自噬的靶标尚不清楚。
基于此,在一项新的研究中,来自美国加州大学圣地亚哥分校、匹兹堡大学、挪威奥斯陆大学和荷兰格罗宁根大学的研究人员推断细胞质组分可能与内质网自噬受体一起发挥功能以便确定这些位点。COPII包被亚基是这些因子的候选对象,这是因为已知它们将膜结构域与剩下的占大部分的内质网结构域分离开来。注定要离开内质网的正确折叠蛋白被COPII包被货物衔接复合物(COPII coat cargo adaptor complex)Sec24-Sec23包装到从内质网出芽并运输到高尔基体的运输囊泡(transport vesicle)中。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation”。
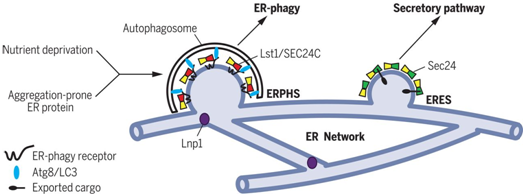
在芽殖酵母中,这些研究人员发现作为Sec24横向同源物的Lst1与Sec23形成COPII货物衔接复合物,是内质网自噬必不可少的。在酵母中,内质网自噬通常用药物雷帕霉素诱导,其中雷帕霉素是一种模拟营养缺乏的TOR激酶抑制剂。雷帕霉素处理能够上调内质网自噬受体Atg40并增加与Lst1-Sec23共定位的Atg40斑点(Atg40 puncta)的数量。Atg40也与Lst1结合。其他的COPII包被亚基(coat subunit)不与Atg40共定位或相互作用。
为了突出内质网的动态变化在内质网自噬中的重要作用,Lst1-Sec23复合物在缺乏Lnp1的细胞中未能与Atg40斑点和Atg8共定位,这是因为缺乏Lnp1的细胞存在内质网自噬缺陷。
与Lst1在包装内质网结构域中的作用相一致的是,内质网自噬期间的Atg40降解需要Lst1。此外,Lst1和Atg40是将内质网结构域押送到自噬体中所需要的。
这些研究人员还发现由过表达的易聚集的分泌蛋白诱导的内质网应激上调Atg40表达,从而降低内质网中的蛋白聚集。TOR依赖性自噬转录调节因子而非未折叠蛋白反应调节Atg40表达。Lst1在内质网自噬中的作用似乎是保守的,这是因为它的哺乳动物同源物SEC24C同样也是内质网自噬所必需的。具体而言,他们发现SEC24C是两种哺乳动物内质网自噬受体FAM134B和RTN3的降解所必需的。SEC24C的功能在中枢神经系统中尤其重要,这是因为它在有丝分裂后神经元中的缺乏会导致它们的死亡。
综上所述,这些研究人员发现了COPII货物衔接复合物Lst1/SEC24C-Sec23在靶向内质网结构域进行自噬方面的非常规功能。Lst1/SEC24C介导的内质网自噬是由营养剥夺或者易聚集蛋白的表达所诱导的。在后一种情况下,内质网自噬阻止内质网中的蛋白聚集。含有Lst1/SEC24C-Sec23的内质网自噬位点(ER-phagy sites, ERPHS)的形成需要Lnp1加以稳定的内质网连接(ER junctions)。ERPHS不同于含有Sec24-Sec23的内质网出口位点(ER exit sites, ERES),其中后者从经典的COPII包被的运输囊泡上出芽。因此,这些研究结果表明COPII货物衔接复合物将不同的货物(ER结构域或输出的蛋白)包装到膜中,随后被引导到不同的途径:内质网自噬或分泌途径。Lst1/SEC24C-Sec23和Sec24-Sec23货物衔接复合物能够通过与内质网跨膜蛋白---内质网自噬受体或输出的蛋白---的细胞质结构域发生相互作用来分选不同的货物。这些不同的内质网运输途径受到各自的应激反应途径的调节。内质网自噬依赖于TOR依赖性自噬转录调节因子,而分泌途径中的蛋白稳态受到未折叠蛋白反应的调节。(生物谷 Bioon.com)
参考资料:
Yixian Cui et al. A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation. Science, 2019, doi:10.1126/science.aau9263.
作为一种替代性处理途径,内质网自噬(ER-phagy)靶向易聚集蛋白位于内质网中的结构域(即内质网结构域)并将它们押送到自噬体中以便将它们递送至液泡或溶酶体中进行降解。当诱导内质网自噬时,内质网自噬受体将它们的结合伴侣---酵母中的Atg8或哺乳动物中的LC3---招募到内质网的离散位点上,从而促进自噬体形成。这些位点形成于高度动态的由Lnp1加以稳定的管状内质网网络上,其中Lnp1是一种位于管状内质网连接处的保守蛋白。尽管内质网自噬发生在连续内质网网络的离散位点上,但是将内质网装载到自噬体中的受体分散于这个内质网网络中。内质网上的特定位点如何成为内质网自噬的靶标尚不清楚。
基于此,在一项新的研究中,来自美国加州大学圣地亚哥分校、匹兹堡大学、挪威奥斯陆大学和荷兰格罗宁根大学的研究人员推断细胞质组分可能与内质网自噬受体一起发挥功能以便确定这些位点。COPII包被亚基是这些因子的候选对象,这是因为已知它们将膜结构域与剩下的占大部分的内质网结构域分离开来。注定要离开内质网的正确折叠蛋白被COPII包被货物衔接复合物(COPII coat cargo adaptor complex)Sec24-Sec23包装到从内质网出芽并运输到高尔基体的运输囊泡(transport vesicle)中。相关研究结果发表在2019年7月5日的Science期刊上,论文标题为“A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation”。

图片来自Science, 2019, doi:10.1126/science.aau9263。
在芽殖酵母中,这些研究人员发现作为Sec24横向同源物的Lst1与Sec23形成COPII货物衔接复合物,是内质网自噬必不可少的。在酵母中,内质网自噬通常用药物雷帕霉素诱导,其中雷帕霉素是一种模拟营养缺乏的TOR激酶抑制剂。雷帕霉素处理能够上调内质网自噬受体Atg40并增加与Lst1-Sec23共定位的Atg40斑点(Atg40 puncta)的数量。Atg40也与Lst1结合。其他的COPII包被亚基(coat subunit)不与Atg40共定位或相互作用。
为了突出内质网的动态变化在内质网自噬中的重要作用,Lst1-Sec23复合物在缺乏Lnp1的细胞中未能与Atg40斑点和Atg8共定位,这是因为缺乏Lnp1的细胞存在内质网自噬缺陷。
与Lst1在包装内质网结构域中的作用相一致的是,内质网自噬期间的Atg40降解需要Lst1。此外,Lst1和Atg40是将内质网结构域押送到自噬体中所需要的。
这些研究人员还发现由过表达的易聚集的分泌蛋白诱导的内质网应激上调Atg40表达,从而降低内质网中的蛋白聚集。TOR依赖性自噬转录调节因子而非未折叠蛋白反应调节Atg40表达。Lst1在内质网自噬中的作用似乎是保守的,这是因为它的哺乳动物同源物SEC24C同样也是内质网自噬所必需的。具体而言,他们发现SEC24C是两种哺乳动物内质网自噬受体FAM134B和RTN3的降解所必需的。SEC24C的功能在中枢神经系统中尤其重要,这是因为它在有丝分裂后神经元中的缺乏会导致它们的死亡。
综上所述,这些研究人员发现了COPII货物衔接复合物Lst1/SEC24C-Sec23在靶向内质网结构域进行自噬方面的非常规功能。Lst1/SEC24C介导的内质网自噬是由营养剥夺或者易聚集蛋白的表达所诱导的。在后一种情况下,内质网自噬阻止内质网中的蛋白聚集。含有Lst1/SEC24C-Sec23的内质网自噬位点(ER-phagy sites, ERPHS)的形成需要Lnp1加以稳定的内质网连接(ER junctions)。ERPHS不同于含有Sec24-Sec23的内质网出口位点(ER exit sites, ERES),其中后者从经典的COPII包被的运输囊泡上出芽。因此,这些研究结果表明COPII货物衔接复合物将不同的货物(ER结构域或输出的蛋白)包装到膜中,随后被引导到不同的途径:内质网自噬或分泌途径。Lst1/SEC24C-Sec23和Sec24-Sec23货物衔接复合物能够通过与内质网跨膜蛋白---内质网自噬受体或输出的蛋白---的细胞质结构域发生相互作用来分选不同的货物。这些不同的内质网运输途径受到各自的应激反应途径的调节。内质网自噬依赖于TOR依赖性自噬转录调节因子,而分泌途径中的蛋白稳态受到未折叠蛋白反应的调节。(生物谷 Bioon.com)
参考资料:
Yixian Cui et al. A COPII subunit acts with an autophagy receptor to target endoplasmic reticulum for degradation. Science, 2019, doi:10.1126/science.aau9263.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


